Известно, что бетулин и его природные и синтетические производные обладают широким спектром биологической активности. С целью поиска новых биологически активных соединений на основе возобновляемого растительного сырья в лаборатории медицинской химии НИОХ ведётся работа по химической модификации природных веществ, в том числе бетулина и бетулиновой кислоты. В данной дипломной работе осуществлен синтез цианпроизводных тритерпеноидов лупанового ряда как реакцией цианэтилирования тритерпеноидов, так и путём химической трансформации соединений, уже содержащих в своей структуре цианэтильную группу.
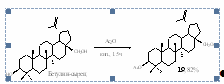
Первым этапом дипломной работы является получение исходных веществ, необходимых для выполнения поставленной задачи. Объектом исследования, а также исходным для синтеза тритерпеноидов: 3β–ацетилбетулина 41, бетулиновой кислоты 5, её метилового эфира 6, оксима метилового эфира 3-оксобетулиновой кислоты 73, необходимых для выполнения данной работы, является бетулин, содержащийся в коре белой берёзы. Бетулин-сырец, выделенный в Опытном химическом цехе НИОХ из бересты горячей экстракцией трихлорэтиленом, был очищен нами через его диацетат 19 (схема 22) с последующей хроматографией его на окиси алюминия.
Схема 22
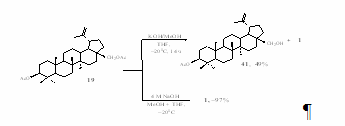
Щелочной гидролиз хроматографически очищенного диацетата бетулина 19 даёт 3β-ацетилбетулин 41 и (или) бетулин 1 в зависимости от количества используемой щёлочи и времени реакции (схема 23). Так, при взаимодействии диацетата бетулина 19 с небольшим избытком метанольного раствора KOH (время реакции 14 ч) образуется смесь 3β-ацетилбетулина 41 и бетулина 1. Соединение 41 было выделено из реакционной смеси с выходом 49% методом колоночной хроматографии на окиси алюминия. В качестве элюента использовали хлороформ. При увеличении количества щёлочи и времени реакции гладко образуется бетулин 1, содержащий по данным спектра ПМР ~5% лупеола. Такого качества бетулин 1 использовали далее без дополнительной очистки для получения 3-оксобетулиновой кислоты 7.
Схема 23
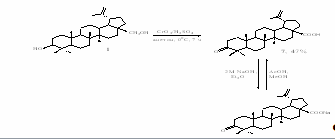
Синтез этой кислоты описан в различных работах (см. литерат. обзор). Мы использовали методику, разработанную в лаборатории медицинской химии НИОХ, а именно окисление бетулина 1 реактивом Джонса в ацетоне при 00С в течение 7 часов (схема 24). Полученную 3-оксобетулиновую кислоту 7 очищали через её натриевую соль, нерастворимую в серном эфире в отличие от имеющихся примесей.
Схема 24
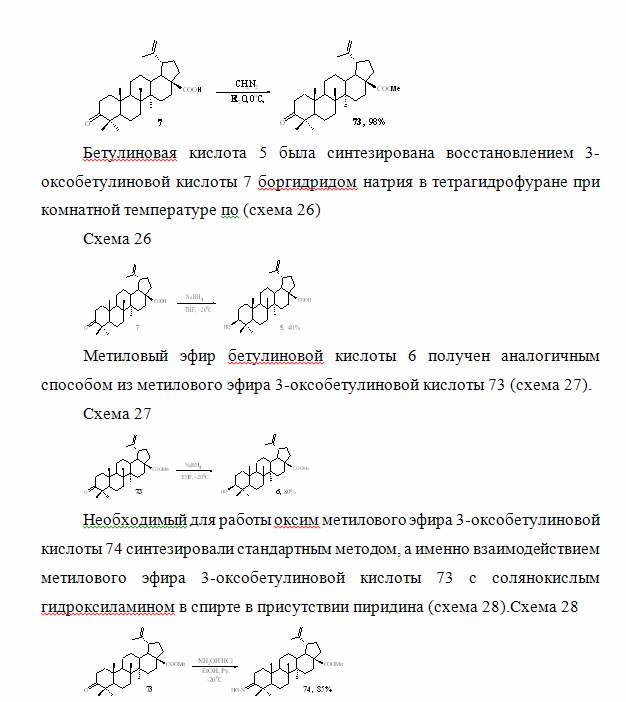
Из 3-оксобетулиновой кислоты 7 была синтезирована бетулиновая кислота 5 и метиловый эфир 3-оксобетулиновой кислоты 73. Так, последний был получен практически с количественным выходом с помощью диазометана в серном эфире (схема 25).
Схема 25
бетулина 1 и его ацильного производного 41, бетулиновой кислоты 5 и её метилового эфира 6, а также оскима 3-оксобетулиновой кислоты 74.
Под реакцией цианэтилирования понимают замещение атома водорода на β-цианэтильную группу действием нитрила акриловой кислоты (ак-рилонитрила) на вещества, обладающие подвижным атомом водорода:
R-H + H2C=CHCN → R-CH2CH2CN
Особенно легко реагируют с акрилонитрилом галоидоводороды, амины, спирты, соединения типа малонового эфира и др. Таким образом, реакция цианэтилирования в узком смысле слова сводится к введению β-цианэтильной группы вместо атома водорода путём присоединения акрилонитрила. Цианэтилирование проводят в различных условиях в зависимости от химических свойств второго компонента. В спиртах поляризация связи между атомами кислорода и водорода выражена слабо, поэтому реакция идёт только под действием щелочных агентов. Известно, что соли четвертичных аммониевых оснований, например хлористый триметилбензиламмоний, ускоряют реакцию присоединения хлористого водорода к акрилонитрилу. Выходы продуктов цианэтилирования спиртов повышаются, если брать один из компонентов в избытке, так как реакция цианэтилирования в какой-то мере обратима. В качестве растворителя можно применять бензол, диоксан, пиридин, ацетонитрил, трет-бутиловый спирт.
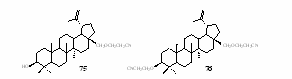
Бетулин 1 содержит две спиртовые группы и таким образом может вступать в реакцию цианэтилирования по обеим группам, при этом возможно образование двух соединений: монозамещённого продукта 75 и дизамещённого соединения 76.
Нами показано, что взаимодействие бетулина 1 с акрилонитрилом в присутствии основания действительно приводит к образованию смеси этих соединений, которые были выделены из реакционной смеси методом колоночной хроматографии на Al2O3, используя в качестве элюента смесь гексана и хлороформа в соотношении 1:1 (схема 29).Схема 29
Структура полученных соединений 75 и 76 доказана данными эле-ментного анализа, масс-, ИК-, ЯМР-спектров. Так, в ИК-спектрах получен-ных соединений 75 (рис. 1) и 76 наблюдаются полосы поглощения при 2265 см-1 и 2251 см-1, соответствующие валентным колебаниям CN-группы.
На рисунках 2 и 3 приведены ПМР-спектры соединений 75 и 76, которые помимо характеристичных сигналов протонов (Н3, Н28, Н29) содержат сигналы протонов CH2CH2CN-групп. Полное отнесение сигналов в этих спектрах, а также в спектрах ЯМР 13С было сделано на основании двумерных спектров ЯМР (протон-протонная и углерод-протонная корреляция) этих соединений с использованием литературных данных по бетулину и его производным.
Варьируя условия реакции цианэтилирования, можно в какой-то степени изменять количественный состав реакционной смеси. Так, нами найдено, что добавление ТЭБАХ к реакционной смеси увеличивает выход дизамещённого продукта 76 до 80% по данным спектра ПМР. Попытки получения продукта 76 без примеси монозамещённого соединения 75 путём увеличения выдержки реакции (до 4-х суток), нагревания реакционной смеси (до 600С), а также значительного увеличения количества акрилонитрила (до 110 ммоль на 1 ммоль бетулина) – не увенчались успехом. Исследование влияния щёлочи на реакцию цианэтилирования показало, что состав образующейся смеси принципиально не зависит от типа щёлочи (табл.3). Возможно, выход дизамещённого продукта 76 повышается при использовании 30% KOH или NaOH. Однако следует отметить, что при увеличении количества акрилонитрила концентрация щёлочи мало влияет на соотношение соединений 75 и 76. Таким образом, нами найдено, что достаточно подходящими условиями для получения дизамещенного соединения 76 является проведение реакции с избытком акрилонитрила в диоксане в присутствии 30% КОН и ТЭБАХ при комнатной температуре в течение суток.
Далее нами была проведена реакция цианэтилирования бетулиновой кислоты 5 и её метилового эфира 6. Реакцию проводили в диоксане в присутствии 30% щёлочи и ТЭБАХ при комнатной температуре в течение суток.
Список использованной литературы
- Толстиков А.Г., Флехтер О.Б., Шульц Э.Э., Балтина Л.А., Толстиков А. Г. Бетулин и его производные. – Химия и биологическая активность // Химия в интересах устойчивого развития, 2005, № 3.
- Петренко Н.И., Еланцева Н.В., Петухова В.З., Шакиров М.М., Щульц Э.Э., Толстиков Г.А. Синтез производных бетулоновой кислоты, содержащих аминокислотные фрагменты // ХПС, 2002, № 4.
- Коровин А.В., Ткачёв А.В. Синтез хиноксалинов, конденсированных тритерпенами, производных урсоловой кислоты и бетулина // Известия Академии наук. Серия химическая, 2001, № 2.
- Митрофанов Д.В., Петухова Н.И., Флехтер О.Б., Галин Ф.З., Зорин В.В. Поиск микроорганизмов для ацилирования бетулина // Баш. Хим. Журн., 2003, т. 10, № 1.

Свежие комментарии